Публикации

Обзор:
Авторы анализируют современное состояние проблемы формирования зоны кератинизированной прикрепленной десны в дентальной имплантологии. Апикальное смещение лоскута с фиксацией свободного десневого трансплантата (СДТ) считается золотым стандартом в пластической хирургии мягких тканей полости рта. Отмечено, что надкостничное или соединительнотканное ложе служит важным условием реваскуляризации и приживления трансплантата. СДТ, пересаженные на надкостницу, нередко оказываются клинически подвижными, при этом пересадка СДТ на кость при полной иммобилизации предсказуемо дает зону кератинизированной десны с более плотным прикреплением. Указан особый приоритет развития специфических техник и методов фиксации СДТ на костное ложе. Изучение методов ригидной фиксации трансплантатов, а также клеточных и молекулярных механизмов, определяющих динамику регенераторных процессов на границе трансплантат – ложе, имеет большой клинический потенциал.
Долгосрочный клинический успех дентальной имплантологии зависит от множества факторов. Среди них можно отметить состояние здоровья пациента и уровень самостоятельной гигиены полости рта, особенности хирургического протокола. Не менее важны геометрия имплантата и химический состав, макро- и микротекстура его поверхности [1-3], вид ортопедической конструкции, а также объем костной ткани и тип слизистой оболочки, формирующей манжету вокруг имплантата. Значение этого последнего фактора, несмотря на большой объем накопленных сведений, активно обсуждается. До сих пор нет единого мнения об оптимальных методах и принципиальной необходимости создания зоны кератинизированной прикрепленной десны в области имплантатов. В настоящей работе представлен обзор данных о клинических и морфологических аспектах пересадки свободного десневого трансплантата.
Мягкие ткани в области зубов представлены двумя типами слизистой оболочки: десной и альвеолярной слизистой оболочкой. Первый тип имеет прикрепление и кератинизацию, а второй подвижен и некератинизирован. Вокруг имплантатов состояние слизистой оболочки закономерно меняется. Имплантаты могут быть окружены кератинизированной и некератинизированной слизистой оболочкой, но, несмотря на кератинизацию, слизистая оболочка не всегда плотно прикрепляется к кости и зачастую подвижна. Прикрепление и кератинизация в данном случае невзаимозависимы, что обусловлено анатомией, изменившейся вследствие утраты зуба. Периодонтальная связка имеет минимум эластических волокон, поэтому в области зубов практически всегда формируется полоса плотно прикрепленной кератинизированной десны [4]. В слизистой оболочке манжеты вокруг имплантата в среднем меньше фибробластов и больше коллагеновых волокон, что делает ее похожей на рубец [5]. Соединительнотканные волокна в ней направлены преимущественно параллельно титановой поверхности пришеечной части имплантата, что даже при наличии кератинизации не гарантирует прикрепления [6].
Существуют противоречивые мнения о влиянии прикрепления и кератинизации слизистой оболочки в области десневой манжеты имплантата на функцию и отсроченные результаты лечения [7-10]. Поскольку имплантация может проводиться в зоне атрофии твердых и мягких тканей, в большинстве случаев в области установленного имплантата имеется подвижная слизистая оболочка и мелкое преддверие. После костнопластических манипуляций преддверие нередко полностью отсутствует, мышечное прикрепление смещается коронально, а в области манжеты вплетаются тяжи и уздечки, что делает ее еще менее стабильной [11]. Мелкое преддверие и нестабильная манжета из некератинизированной слизистой оболочки способствуют скоплению налета вокруг имплантата, развитию воспаления и появлению кровоточивости [12, 13]. Подвижная слизистая оболочка менее устойчива к механическим нагрузкам, затрудняет гигиенические манипуляции и снижает комфорт пациента [14]. Она способствует рецессии мягких тканей в области имплантатов [15, 16], поскольку движение вестибулярной слизистой оболочки вовлекает десневой край [17]. Имплантаты без достаточного объема кератинизированной десны более подвержены убыли костной ткани [18-21] и возникновению периимплантита [22,23]. В эстетически значимой зоне возникает еще одна проблема – визуализация шеек имплантатов и абатментов сквозь тонкий слой некератинизированной слизистой оболочки [24].
В связи с этим большой интерес имплантологов сосредоточен на работе с мягкими тканями в области имплантатов. Основная цель при этом – создание плотной манжеты в области имплантата за счет формирования зоны кератинизированной прикрепленной десны. Однако кератинизацию с плотным прикреплением удается получить не во всех случаях. Так, В. Dordick и соавт. [25] показали, что многие свободные десневые трансплантаты (СДТ), которые исходно были неподвижны, в дальнейшем проявляют клиническую подвижность. Это не “плавающие” трансплантаты в том смысле, что они абсолютно свободно двигаются со слизистой оболочкой или поднимаются над поверхностью альвеолярного отростка, но они сдвигаются инструментом, например, зондом, в передне-заднем и апикально-корональном направлении. Очевидно, что изначальная цель – создание функциональной полоски плотно прикрепленных кератинизированных тканей – в таком случае не достигается. Значение подвижного трансплантата неясно. Можно полагать, что он представляет собой промежуточный тип по отношению к кератинизированной прикрепленной десне и подвижной альвеолярной слизистой и, как следствие, может быть более предрасположен к возникновению проблем, чем плотно прикрепленная полоса слизистой оболочки жевательного типа. Ее роль в стабилизации манжеты и причины возникновения подвижности трансплантатов в реципиентной зоне во многом определяются гистологическими особенностями этих тканей.
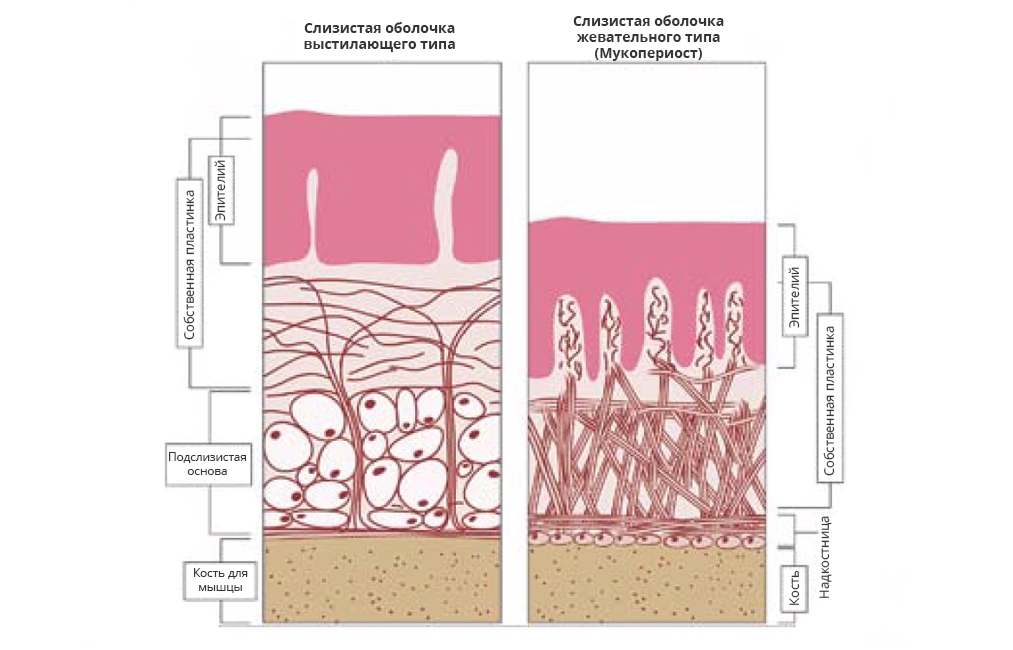
Рис. 1. Два основных типа слизистой оболочки полости рта (схема).
Слева – слизистая оболочка выстилающего типа, подвижная, некератинизированная. Справа – слизистая оболочка жевательного типа, плотно спаянная с подлежащей тканью и кератинизированная, также называемая “мукопериост”.
Жевательная слизистая оболочка (рис. 1, справа) покрывает неподвижные структуры, подверженные давлению и трению пищевым комком, – альвеолярные гребни, твердое небо и бугры верхней челюсти. Эпителий здесь умеренно утолщен, является многослойным плоским ороговевающим – имеет ортокератинизацию, хотя встречаются и участки с паракератозом, которые также считаются нормой. Оба варианта слизистой малоэластичны и хорошо переносят механическое воздействие при жевании. Переход эпителия в собственную пластинку трудноразличим, большое количество соединительнотканных сосочков обеспечивает плотный контакт с эпителием и предотвращает его отрыв при сдвигающих нагрузках. Собственная пластинка достаточно толстая, она представлена коллагеновыми волокнами, собранными в крупные, плотно упакованные пучки, которые тянутся между якорными точками. Такая ткань неподатлива и устойчива к давлению. В области десны ее васкуляризация невысокая, однако в сосочках, контактирующих с эпителием, имеются длинные капиллярные петли с множеством анастомозов. В области же твердого неба васкуляризация умеренная с короткими капиллярными петлями. Подслизистая основа по своему строению варьирует в зависимости от зоны. Она может быть связана с подлежащими неподвижными структурами напрямую, прикрепляясь собственной пластинкой к надкостнице и формируя мукопериост, или опосредованно – через фиброзную подслизистую основу. В латеральных областях неба эта подслизистая основа перемежается с участками жировой и железистой ткани, которые являются амортизаторами при механических нагрузках и защищают подлежащие сосуды и нервы [26]. Особенности архитектоники слизистой оболочки жевательного типа дают ей механическую устойчивость, выраженную каркасность по сравнению с искусственными аналогами и высокий оперативный потенциал при трансплантации. Такие свойства идеальны для переноса в область имплантатов при формировании плотной герметичной десневой манжеты.
Как уже упоминалось, в большинстве случаев исходно манжета вокруг имплантата представлена выстилающей слизистой оболочкой (см. рис. 1, слева) – подвижной и некератинизированной. Такой тип слизистой оболочки выстилает большую часть полости рта, включая альвеолярные гребни апикальнее мукогингивальной линии. Поверхность эластична и способна выдерживать растяжение. Граница перехода эпителия в соединительную ткань гладкая, хотя отдельные соединительнотканные сосочки могут выступать в толщу эпителия. Собственная пластинка толще, чем в области жевательной слизистой, и содержит меньше коллагеновых волокон, которые иррегулярно направлены между якорными точками. Такая слизистая может растягиваться до некоторого предела, когда эти волокна распрямляются и ограничивают дальнейшую деформацию. Вместе с коллагеновыми волокнами эластические также участвуют в контроле растяжимости слизистой. Альвеолярная слизистая и слизистая дна полости рта свободно прикреплены к подлежащим структурам за счет толстой подслизистой основы. Эластические волокна этого слоя возвращают слизистую в исходное положение после смещения. Выстилающая слизистая склонна к растяжимости, имеет рыхлую и зачастую эластичную подслизистую основу [26]. Несомненно, выполняя свою функцию, такая слизистая не должна окружать не свойственные ей структуры, она не предназначена для формирования десневой манжеты.
Специфичность эпителия (наличие или отсутствие кератинизации) определяется типом подлежащей соединительной ткани [27-29]. Отсутствие эластических волокон в соединительной ткани критично для наличия кератинизации [30]. Поэтому трансплантаты, содержащие субэпителиальную соединительную ткань, например, твердого неба, при пересадке в область, изначально покрытую некератинизированной слизистой, могут индуцировать кератинизацию.
Существуют разные методы формирования кератинизированной прикрепленной десны. Одним из самых распространенных и эффективных в настоящее время является вестибулопластика с апикальным смещением лоскута и пересадкой СДТ [31]. Она считается золотым стандартом [32, 33] в мягкотканой пластике. Среди донорских зон предпочтение в основном отдается твердому небу и иногда области бугра верхней челюсти. Несмотря на то, что СДТ обычно рассматривается в упрощенном виде, твердое небо многослойно.
Оно содержит эпителий, подслизистую основу, жировую ткань, железистую ткань и надкостницу. Каждый из этих слоев по-разному ведет себя при трансплантации. Жировая ткань рассасывается и утрачивает объем, железистая ткань может препятствовать реваскуляризации или приводить к образованию ретенционных кист, а о значении надкостницы говорить затруднительно, поскольку не всегда можно гарантировать полный ее перенос в трансплантат. Поэтому в СДТ предпочтительно наличие только двух слоев: эпителия, выполняющего защитную функцию в раннем послеоперационном периоде, и собственной пластинки, несущей основной регенераторный потенциал и определяющей степень кератинизации покрывающего ее эпителия.
Жизнеспособность, последующее приживление трансплантата или лоскута, а значит и успех операции – напрямую зависят от наличия достаточного питания, поэтому одной из ключевых в трансплантологии является проблема трофического компонента. Питание может идти из донорского участка или принимающей зоны, в связи с чем можно отметить два аспекта – донорский трофический компонент и реципиентный, которые тесно взаимосвязаны. По характеру кровоснабжения донорской ткани ее можно разделить на два типа: трансплантаты и лоскуты.
Трансплантаты полностью лишены какого-либо кровоснабжения и сразу после пересадки получают питание исключительно за счет плазматической циркуляции из тканей принимающего ложа [34-37].
Лоскуты получают кровоснабжение из донорской зоны. Они могут быть на ножке (одной или нескольких) или свободные, на сформированном после пересадки микрососудистом анастомозе. Важным параметром жизнеспособности всех лоскутов является суммарный диаметр питающих сосудов, а также отношение длины питающего основания к его ширине. Достоинство лоскутов – изначальное присутствие трофического компонента в виде центрального сосуда либо суммы мелких сосудов и капилляров. Однако некоторые особенности лоскутов серьезно ограничивают их применение в полости рта. Необходимость соблюдения топографии сосудистого русла для обеспечения жизнеспособности лоскута и выход некоторых крупных сосудов через костные отверстия не позволяют провести достаточную мобилизацию. Наличие зубного ряда и участков с выраженной кривизной поверхности приводит к возникновению перегибов и натяжения основания лоскутов, что нарушает его питание и увеличивает риск некроза. В связи с этим предпочтение отдается использованию трансплантатов или сочетания трансплантатов и локальных лоскутов, такие вмешательства менее травматичны и более предсказуемы. Успешное приживление во многом зависит от устойчивости тканей лоскута или трансплантата к воздействию гипоксии, от площади аваскулярных зон в принимающем ложе и, что не менее важно, от плотности фиксации донорской ткани к ложу. Основные биологические этапы приживления трансплантатов (рис. 2) показаны в экспериментах на животных, проведенных R.C. Oliver [34] и T. Nobuto [38].
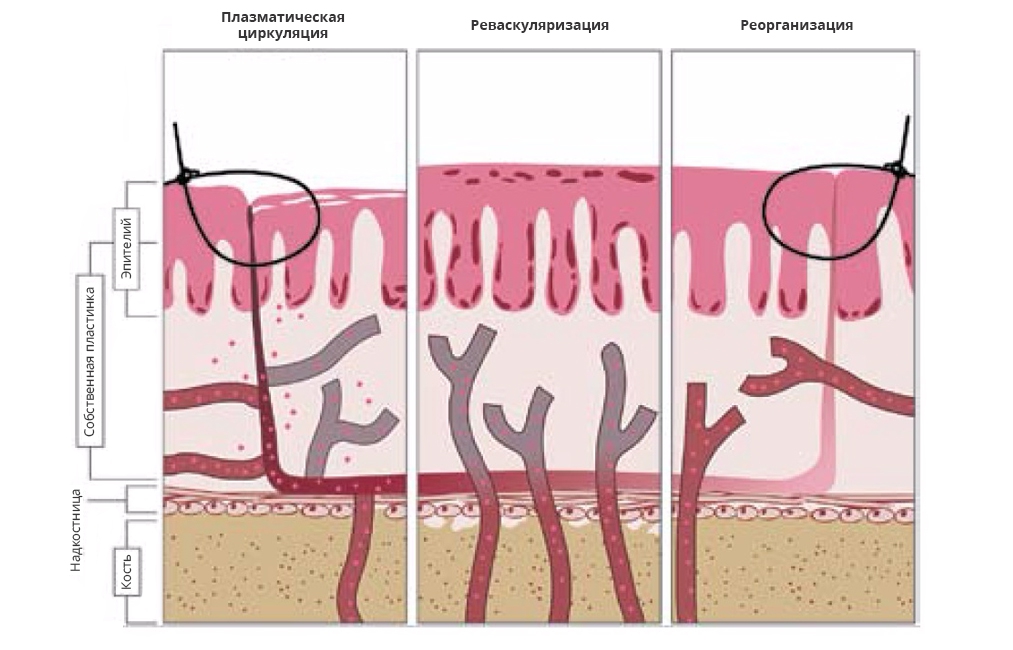
Рис. 2. Этапы приживления свободного десневого трансплантата (схема).
Слева – плазматическая циркуляция (0–3-е сутки). Питание за счет диффузии веществ по градиенту концентрации от ложа к трансплантату. В процессе частично участвуют сосуды трансплантата, который отделен от ложа фибриновым сгустком. В центре – реваскуляризация (3–11-е сутки). Сосуды принимающего ложа соединяются с сосудами трансплантата, восстанавливается кровоснабжение. Начинается поверхностная резорбция кортикальной пластинки. Она происходит вне зависимости от наличия или отсутствия надкостницы. Справа – реорганизация (11–42-е сутки). Микроциркуляторное русло трансплантата полностью перестраивается, его плотность снижается. В результате активной деятельности фибробластов идет перестройка коллагенового матрикса. Явления резорбции сменяются отложением остеоида и его дальнейшей минерализацией, полностью компенсируя первичную резорбцию.
Плазматическая циркуляция (0–3-и сутки). Тонкий слой экссудата из сосудов принимающего ложа обеспечивает первичное питание трансплантата, происходит обмен воды, электролитов и других веществ, содержащихся в плазме. Это не активное явление обмена веществ, а чисто физический процесс (диффузия), названный плазматической циркуляцией. Это не только плазматическое имбибирование, поскольку просто пропитывание трансплантата плазмой не обеспечивает достаточного питания, процесс является именно циркуляцией [39]. Эпителий свободного десневого трансплантата в этой фазе десквамируется, однако остается слой базальных клеток эпителия.
Реваскуляризация (3–11-е сутки). На 3–4-е сутки после пересадки по границе трансплантат-ложе образуется васкулярный слой, параллельный костной поверхности, анастомозы начинают соединять существующую сосудистую сеть в трансплантате с кровеносными сосудами принимающего ложа. Слой экссудата избыточной толщины при плохой адаптации трансплантата к ложу препятствует прорастанию сосудов и образованию анастомозов, что приводит к дефициту питания и возможному некрозу. Поэтому плотный контакт трансплантата и реципиентной зоны крайне важен. В фазе реваскуляризации происходит соединение глубоких слоев соединительной ткани трансплантата и принимающего ложа. Сосудистая система и соединительная ткань играют основную роль в так называемом мезенхимальном ответе [38]. Эпителиальный слой свободного десневого трансплантата, претерпевший десквамацию в предыдущей фазе, восстанавливается. В эпителизации участвуют края реципиентной зоны, а также клетки самого трансплантата – базальные кератиноциты, оставшиеся в глубоких слоях эпителиальных гребешков, вдоль базальной мембраны.
Реорганизация (11–42-е сутки). Во время фазы реорганизации множественные новообразованные сосуды в трансплантате редуцируются. Соединительная ткань созревает: фибробласты уменьшаются в количестве и размере, в межклеточном веществе активно откладываются коллагеновые волокна. Эпителиальный слой также созревает, происходит кератинизация его поверхности.
Существует устоявшееся мнение, что СДТ необходимо фиксировать на надкостницу или соединительную ткань, с предположением, что это способствует реваскуляризации, минимизирует резорбцию кортикальной костной пластинки и дает наиболее благоприятное заживление. Однако в ряде исследований [25, 40–42] отмечается периодически встречающаяся клиническая подвижность СДТ после его пересадки и приведена взаимосвязь данного явления с наличием надкостницы в принимающем ложе. Гистологическое строение надкостницы позволяет понять причины таких клинических результатов.
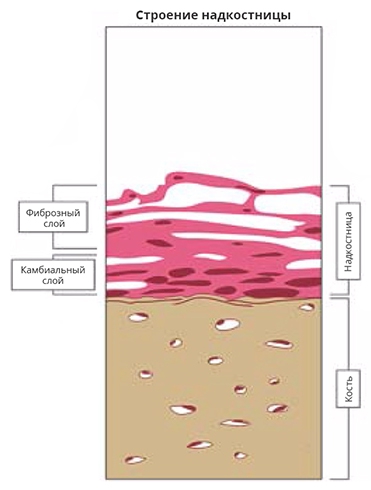
Рис. 3. Строение надкостницы (схема).
Камбиальный слой содержит остеогенные клетки-предшественники и остеобласты. В фиброзном слое в основном находятся фибробласты.
Надкостница (рис. 3) – специализированная волокнистая ткань, которая формирует хорошо васкуляризованную фиброзную оболочку и выстилает внешнюю поверхность костей, кроме суставных поверхностей и сесамовидных костей [43]. Она состоит из плотной соединительной ткани нерегулярного строения и разделяется на внешний (фиброзный слой) и внутренний (камбиальный слой) – слой клеток толщиной 1–2 клеточных пласта, интимно связанный с костной поверхностью. Фиброзный слой главным образом представлен фибробластами, в то время как внутренний слой содержит остеобласты и остеогенные клетки-предшественники [44, 45]. Клетки из камбиального слоя играют роль в росте всех типов кости. В условиях переломов клетки-предшественники могут дифференцироваться в остеобласты и хондробласты, что важно при стабилизации раны. В отличие от кости, надкостница имеет болевые нервные окончания. Она отдает кровеносные и лимфатические сосуды, идущие в кость и из нее. Надкостница – зона фиксации связок и сухожилий мышц за счет плотных коллагеновых волокон в камбиальном слое, шарпеевых волокон, которые продолжаются во внешние слои. С возрастом надкостница перестает отчетливо выделяться и фиброзируется. Выделяют два вида надкостницы. В зоне прикрепленной десны волокна соединительной ткани ориентированы перпендикулярно кости, в зоне, апикальнее мукогингивальной границы, имеются эластические волокна, а соединительнотканные ориентированы параллельно кости [25]. Клинически это проявляется в том, что после иссечения покрывающих тканей надкостница в десневой зоне фиксирована, а апикальнее мукогингивальной границы – зачастую подвижна. Также в зоне подвижной слизистой могут прикрепляться мышечные волокна. В большинстве случаев требуется поместить большую часть трансплантата апикальнее мукогингивальной границы, где имеется потенциально подвижное надкостничное основание. Этот фактор может легко привести к послеоперационной подвижности трансплантата.
Как альтернатива традиционному подходу в работах, указанных ранее [25, 40–42], рассматривается фиксация СДТ непосредственно на кость. Наличие надкостничного ложа в реципиентной зоне не становится обязательной предпосылкой для формирования равномерного микроциркуляторного русла в ткани свободного десневого трансплантата [46]. В эксперименте B. Dordick [25] трансплантаты на надкостнице или на кости на 28-е сутки клинически были трудноотличимы, разницы в заживлении не было. При этом отмечалась меньшая послеоперационная болезненность и улучшенный гемостаз. У трансплантатов на надкостнице в 50% случаев обнаруживалась клиническая подвижность и, наоборот, при фиксации на кость возникало плотное прикрепление трансплантата к подлежащему ложу [25].
В зоне контакта кость–трансплантат образуются новые волокна соединительной ткани, которые прикрепляются к кости [37]. Окраска эластических волокон показывает некоторые различия: у трансплантатов на надкостнице в глубоком слое соединительной ткани, соответствующем зоне предыдущего контакта с принимающим ложем, присутствуют эластические волокна. Подобное распределение наблюдается в подвижной альвеолярной слизистой. Наоборот, у трансплантатов на кости эластические волокна практически отсутствуют [40], организация супраостального слоя соединительной ткани у них напоминает надкостницу.
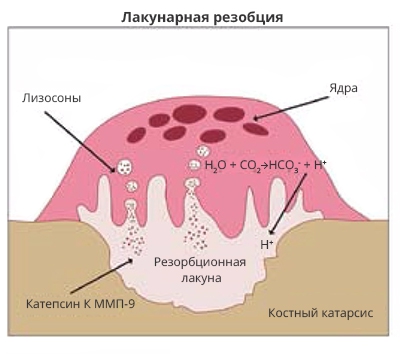
Рис. 4. Лакунарная резорбция (схема).
Активированный остеокласт формирует углубление (лакуну). В области гофрированного края -- множественных складок мембраны остеокласта -- в резорбционную лакуну открываются лизосомы. При этом выделяются протеолитические ферменты, в том числе катепсин К и матриксная металлопротеиназа-9, которые лизируют органический компонент костного матрикса. Также в резорбционную полость активно транспортируются протоны, участвующие в растворении минерального компонента кости.
Несмотря на доказанное участие надкостницы, подлежащее костное основание может брать на себя ее функцию и играть более выраженную роль в столь важном процессе, как раневое заживление. Реакция кости на хирургическое вмешательство характеризуется исходной резорбцией, за которой следует формирование новой кости с последующим созреванием. Очаги ремоделирования кости с лакунами резорбции (рис. 4) присутствуют как при фиксации трансплантата на кость, так и на надкостницу [42]. Костная топография играет определяющую роль в отношении частичного или полного восстановления резорбированной кости. Также на объем резорбции влияет наличие надкостницы и ее толщина. Первоначально может показаться, что костная резорбция – отрицательный фактор, однако она может быть положительна в отношении раневого заживления, поскольку открывает сообщение между элементами костномозговых пространств и зоной, претерпевающей репарацию или регенерацию [42]. Полости, имеющиеся в костном веществе или появляющиеся из-за резорбции, выстланы эндостом, который имеет сходство с камбиальным слоем надкостницы. Поэтому гистологически все элементы надкостницы также присутствуют и в костномозговых пространствах, их содержимое считается даже более богатым недифференцированными клетками и микроваскуляризацией, чем сама надкостница. Таким образом, костномозговые пространства представляют источник регенерации [47] сходный или даже лучший, чем надкостничный. Кортикальная пластинка и надкостница ограничивают участие костномозговых полостей в заживлении.
Поверхностная костная резорбция возникает в раннем послеоперационном периоде, костномозговые пространства активно участвуют в заживлении посредством взаимодействия с надкостницей и, возможно, даже ее замещения [42]. Костная резорбция происходит всегда, но в большинстве случаев она обратима и сменяется полным восстановлением кости с итоговым отсутствием клинических повреждений, в эксперименте Novaes [42] после 28 суток зоны резорбции костной ткани отсутствуют. На 1-й и 2-й неделе после операции в хирургическую зону открываются костномозговые пространства и включаются в репаративный процесс, меняя свою преимущественно жировую природу на фиброзную. В исследовании Novaes оценивалось приживление трансплантатов на кости, а также делались перфорации кортикальной пластинки, чтобы оценить возможное ускорение процесса приживления за счет раннего включения костномозговых пространств в процесс репарации. Авторы отметили врастание коллагеновых волокон трансплантата в микроскопические костномозговые пространства [42], а в зоне перфораций – появление плотных фиброзных тяжей, соединяющих трансплантат и ложе. B. Dordick [25] отмечает, что при пересадке на кость реваскуляризация трансплантата происходит позднее, чем при надкостничной фиксации. Однако при наличии перфораций кортикальной кости задержки васкуляризации не происходит [42].
Указанные исследования показывают, что надкостница служит барьером, исключающим контакт трансплантата и эндоста. Она препятствует врастанию коллагеновых волокон трансплантата в костномозговые пространства и образованию плотной фиброзной спайки.
Скрупулезный анализ данных по пересадке свободного десневого трансплантата позволяет выделить два основных метода – фиксация на надкостницу и на кость. Исследования, посвященные накостной фиксации СДТ, наиболее активно проводились в 1970-е [25, 40, 41, 48] и 1980-е [38, 46, 49, 50] годы. Со временем наметился спад интереса к этой теме: несколько исследований проведено в 1990-е годы [42, 51–53]. После 2000 г. накостная фиксация утратила свое значение и в основном кратко упоминается в обзорных статьях [33, 54], что, по нашему мнению, может быть связано с предпочтениями исследователей, а также сложностью и несовершенством техник накостной фиксации СДТ.
Все авторы делали фиксацию швами и отмечали, что такой способ представляет трудности и не всегда позволяет добиться плотного контакта трансплантата с принимающим ложем. Встречаются и другие методы: фиксация с помощью фибринового клея [55], цианакрилата [56] или стента [57]. В посвященных им исследованиях рассмотрена только трансплантация на надкостницу. Вероятно, это связано с тем, что пересадка на кость с использованием указанных методик может представлять повышенный риск некроза трансплантата. Иногда решением проблемы неплотной фиксации СДТ у M. Merli [58] становится использование микровинтов для остеосинтеза, также представлены только клинические случаи фиксации на надкостницу. Такой способ дает максимальный контакт трансплантата с принимающим ложем, однако крупный размер винтов (от 1,5 @x 4 мм до 1,5 @x 12 мм) и наличие резьбы могут затруднять их использование.
Результаты описанных методов становятся основанием для пересмотра самого понятия “фиксация”. Использование швов не дает достаточной ригидности, в связи с чем трансплантат может сохранять подвижность, несмотря на то, что он фиксирован. Применение винтов, наоборот, создает стабильный и плотный контакт трансплантата с принимающим ложем, но также называется “фиксацией”. Такой двойственности данного понятия можно избежать, используя термин “иммобилизация”, подразумевающий полное отсутствие подвижности фиксированного трансплантата.
Проблема адекватной иммобилизации трансплантата в реципиентной зоне по-прежнему актуальна, а особенности процессов, происходящих в трансплантате и принимающем ложе при пересадке на кость, до конца не выяснены. Необходимы дальнейшие исследования в этих направлениях.
Заключение
Данные, представленные в нашей работе, позволяют сформулировать ряд общих положений и выводов. Кератинизация слизистой оболочки сама по себе не способствует ее прикреплению к твердым тканям принимающего ложа, а участок подвижной слизистой оболочки с кератинизацией не имеет положительного клинического эффекта, потому что не создает плотной манжеты вокруг имплантата. Несмотря на большое количество способов создания зоны кератинизированной прикрепленной десны, не выработано единого представления об оптимальном подходе к фиксации СДТ. Фиксация трансплантата может не включать иммобилизацию, т. е. полное отсутствие его подвижности. Иммобилизация труднодостижима при использовании шовных методик. Устоявшееся мнение, что для создания зоны кератинизированной прикрепленной десны свободный десневой трансплантат необходимо пересаживать на надкостничное ложе, подлежит пересмотру, поскольку нередко в результате получается подвижная кератинизированная десна. Пересадка свободного десневого трансплантата на кость при полной иммобилизации предсказуемо дает зону кератинизированной десны с прикреплением более плотным, чем при пересадке на надкостницу. Необходимы дополнительные исследования методик иммобилизации свободных десневых трансплантатов в реципиентной зоне, а также клеточных и молекулярных механизмов, определяющих динамику регенераторных процессов на границе трансплантат–ложе. Дальнейший прогресс в решении поставленных вопросов зависит от эффективного совмещения методов клинических и морфофункциональных исследований.
Авторы: Едранов С.С., Керзиков Р.А.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
1 Калиниченко С.Г., Матвеева Н.Ю., Костив Р.Е., Пузь А.В. Сосудистый эндотелиальный фактор роста и трансформирующий фактор роста-b2 в костной ткани крыс при установке после перелома титановых имплантатов с биоактивными биорезорбируемыми покрытиями. Бюллетень экспериментальной биологии и медицины. 2016; 162 (11): 626–31.
2 Плехова Н.Г., Ляпун И.Н., Калиниченко С.Г., Матвеева Н.Ю., Костив Р.Е., Гнеденков С.В. и др. Влияние биоинертных и биорезорбируемых металлических имплантатов на экспрессию мембранных рецепторов дендритных клеток. Современные проблемы науки и образования. 2015; 5: 181–4.
3 Матвеева Н.Ю., Костив Р.Е., Калиниченко С.Г., Пузь А.В., Плехова Н.Г. Динамика регенерации перелома бедренной кости крыс с применением титанового имплантата с поверхностно активным покрытием. Международный журнал прикладных и фундаментальных исследований. 2015; 10 (5): 849–53.
4 Karring T., Östergaard E., Löe H. Conservation of tissue specifically after heterotopic transplantation of gingiva and alveolar mucosa. J. Periodon- tal Res. 1971; 6 (4): 282–93.
5 Kim S.S. et al. Regulation of matrix remodelling phenotype in gingival fibroblasts by substratum topography. J. Cell. Mol. Med. 2015; 19 (6): 1183–96.
6 Berglundh T., Lindhe J., Ericsson I., Marinello C.P., Liljenberg B., Thomsen P. The soft tissue barrier at implants and teeth. Clin. Oral Implants Res. 1991; 2 (2): 81–90.
7 Wennström J.L., Derks J. Is there a need for keratinized mucosa around implants to maintain health and tissue stability? Clin. Oral Implants Res. 2012; 23 (Suppl. 6): 136–46.
8 Brito C., Tenenbaum H.C., Wong B.K.C., Schmitt C., Nogueira-Filho G. Is keratinized mucosa indispensable to maintain peri-implant health? A systematic review of the literature. J. Biomed. Mater. Res. Part B Appl. Biomater. 2014; 102 (3): 643–50.
9 Ladwein C., Schmelzeisen R., Nelson K., Fluegge T.V., Fretwurst T. Is the presence of keratinized mucosa associated with periimplant tissue health? A clinical cross-sectional analysis. Int. J. Implant Dent. 2015; 1 (1): 1.
10 Roccuzzo M., Grasso G., Dalmasso P. Keratinized mucosa around implants in partially edentulous posterior mandible: 10-year results of a prospective comparative study. Clin. Oral Impl. Res. 2016; 27 (4): 491–6.
11 Sevor J.J. The use of free gingival grafts to improve the implant soft tissue interface: rationale and technique. Pract. Periodontics Aesthet. Dent.: PPAD. 1992; 4 (9): 59–64.
12 Crespi R., Cappare P., Gherlone E. A 4-year evaluation of the peri-implant parameters of immediately loaded implants placed in fresh extraction sockets. J. Periodontol. 2010; 81 (11): 1629–34.
13 Lin G.H., Chan H.L., Wang H.L. The significance of keratinized mucosa on implant health: a systematic review. J. Periodontol. 2013; 84 (12): 1755–67.
14 Souza A. B., Tormena M., Matarazzo F., Araújo M. G. The influence of peri-implant keratinized mucosa on brushing discomfort and peri-implant tissue health. Clin. Oral lmpl. Res. 2016; 27 (6): 650–5.
15 Bengazi F., Wennstrom J.L., Lekholm U. Recession of the soft tissue margin at oral implants. A 2-year longitudinal prospective study. Clin. Oral lmpl. Res. 1996; 7 (4): 303–10.
16 Zigdon H., Machtei E.E. The dimensions of keratinized mucosa around implants affect clinical and immunological parameters. Clin. Oral Impl. Res. 2008; 19 (4): 387–92.
17 Rapley J.W., Mills P.M., Wylam J. Soft tissue management during implant maintenance. Int. J. Perio. & Res. Dent. 1992; 12 (5): 373–81.
18 Linkevicius T., Apse P., Grybauskas S., Puisys A. The influence of soft tissue thickness on crestal bone changes around implants: a 1-year prospective controlled clinical trial. Int. J. Oral Maxillofac. Impl. 2009; 24 (4): 712–9.
19 Bengazi F., Botticelli D., Favero V., Perini A., Urbizo Velez J., Lang N.P. Influence of presence or absence of keratinized mucosa on the alveolar bony crest level as it relates to different buccal marginal bone thicknesses. An experimental study in dogs. Clin. Oral lmpl. Res. 2014; 25 (9): 1065–71.
20 Puisys A., Linkevicius T. The influence of mucosal tissue thickening on crestal bone stability around bone-level implants. A prospective controlled clinical trial. Clin. Oral lmpl. Res. 2015; 26 (2): 123–29.
21 Bengazi F., Lang N. P., Caroprese M., Urbizo Velez J., Favero V., Botticelli D. Dimensional changes in soft tissues around dental implants following free gingival grafting: an experimental study in dogs. Clin. Oral lmpl. Res. 2015; 26 (2): 176–82.
22 Warrer K., Buser D., Lang N.P., Karring T. Plaque-induced peri-implantitis in the presence or absence of keratinized mucosa. An experimental study in monkeys. Clin. Oral Impl. Res. 1995; 6 (3): 131–8.
23 Monje A., Galindo-Moreno P., Tözürm T.F., Suárez-López del Amo F., Wang, H.L. Into the paradigm of local factors as contributors for periimplant disease: a short communication Int. J. Oral Maxillofac. Impl. 2016; 31 (2): 288–92.
24 Jung R.E., Sailer I., Hammerle C.H.F., Attin T., Schmidlin P., Dent P.D.M. In vitro color changes of soft tissues caused by restorative materials. Int. J. Periodontics Restor. Dent. 2007; 27 (3): 251–7.
25 Dordick B., Coslet J.G., Seibert J.S. Clinical evaluation of free autogenous gingival grafts placed on alveolar bone: Part I. Clinical predictability. J. periodontol. 1976; 47 (10): 559–67.
26 Nanci A., Ten Cate A.R. Ten Cate’s Oral histology: development, structure, and function. 8th Ed. St. Louis: Mosby Elsevier; 2013.
27 Mackenzie I.C., Hill M.W. Connective tissue influences on patterns of epithelial architecture and keratinization in skin and oral mucosa of the adult mouse. Cell and tissue res. 1984; 235 (3): 551–9.
28 Hill M.W., Mackenzie I.C. The influence of differing connective tissue substrates on the maintenance of adult stratified squamous epithelia. Cell and tissue res. 1984; 237 (3): 473–8.
29 Okazaki M., Yoshimura K., Suzuki Y., Harii K. Effects of subepithelial fibroblasts on epithelial differentiation in human skin and oral mucosa: heterotypically recombined organotypic culture model. Plast. And reconstr. surg. 2003; 112 (3): 784–92.
30 Karring T., Lang N.P., Loe H. The role of gingival connective tissue in determining epithelial differentiation. J. Periodontal Res. 1975; 10 (1): 1–11.
31 Bassetti R.G., Stähli A., Bassetti M.A., Sculean A. Soft tissue augmentation procedures at second-stage surgery: a systematic review. Clin. oral investigations. 2016; 1–19.
32 Matouk M., Sclar A.G. Oral connective tissue grafting: evidence-based principles for predictable success. Oral Maxillofac. Surg. Clin. North Am. 2002; 14 (2): 241–57.
33 Kim D.M., Neiva R. Periodontal soft tissue non–root coverage procedures: a systematic review from the AAP regeneration workshop. J. periodontol. 2015; 86 (2-s): S56–S72.
34 Oliver R.C., Löe H., Karring T. Microscopic evaluation of the healing and revascularization of free gingival grafts. J. Periodontal Res. 1968; 3 (2): 84–95.
35 Janson W.A., Ruben M.P., Kramer G.M., Bloom A.A., Turner H. Development of the blood supply to split-thickness free gingival autografts. J. Periodontol. 1969; 40 (12): 707–16.
36 Guiha R., el Khodeiry S., Mota L., Caffesse R. Histological evaluation of healing and revascularization of the subepithelial connective tissue graft. J. Periodontol. 2001; 72 (4): 470–8.
37 Camargo P.M., Melnick P.R., Kenney E.B. The use of free gingival grafts for aesthetic purposes. Periodontol. 2000. 2001; 27 (27): 72–96.
38 Nobuto T., Imai H., Yamaoka A. Microvascularization of the free gingival autograft. J. Periodontol. 1988; 59 (10): 639–46.
39 Wullstein, H., Wullstein, S. The altered metabolism of the full thickness skin graft. The Laryngoscope. 1972; 82 (11): 1990–9.
40 Caffesse R.G., Burgett F.G., Nasjleti C.E., Castelli W.A. Healing of Free Gingival Grafts With and Without Periosteum. Part I. Histologic Evaluation. J. Periodontol. 1979; 50 (11): 586–94.
41 James W.C., McFall W.T. Placement of free gingival grafts on denuded alveolar bone. Part I: clinical evaluations. J. Periodontol. 1978; 49 (6): 283–90.
42 Belem Novaes A., Belem Novaes Jr. A. Superficial bone resorption: a negative or positive factor in wound healing? Int. J. Periodontics Restor. Dent. 1996; 16 (1): 78–87.
43 Jee W.S. Integrated bone tissue physiology: anatomy and physiology. In: Cowin S.C., ed. Bone mechanics handbook. Boca Raton: CRC Press; 2001: 1–68.
44 Едранов С.С. Роль оксида азота в повреждении и репарации слизистой оболочки верхнечелюстной пазухи. Российский стоматологический журнал. 2012; 6: 38–42
45 Едранов С.С. Посттравматический гайморит: вопросы патогенеза. Экспериментальное и клиническое исследования. Владивосток: Медицина ДВ; 2013.
46 Busschop J., Boever J., Schautteet H. Revascularization of gingival autografts placed on different receptor beds. J. Clin. Periodontol. 1983; 10 (3): 327–32.
47 Едранов С.С. Клеточно-молекулярные аспекты посттравматической регенерации слизистой оболочки околоносовых пазух. Тихоокеанский медицинский журнал. 2016; 2 (64): 67–71.
48 Bissada N.F., Sears S.B. Quantitative assessment of free gingival grafts with and without periosteum and osseous perforation. J. Periodontol. 1978; 49 (1): 15–20.
49 Mörmann W., Schaer F., Firestone A.R. The relationship between success of free gingival grafts and transplant thickness. Revascularization and shrinkage – a one year clinical study. J. Periodontol. 1981; 52 (2): 74–80.
50 Nawa Y. Experimental study of free gingival grafts. A comparative reference of the periosteal bed and the denuded bone bed. J. Japan Societ. Periodontolog. 1988.
51 Yanagihara K. Experimental studies on morphological changes of microvascular architecture following the free gingival autograft on denuded alveolar bone. J. Japan. Societ. Periodontolog. 1990; 32 (1): 45–70. (in Japanese).
52 Tamaki O. Tissue from repair the aspect after free gingival graft with and without of the periosteum periodontium of destruction and regeneration. J. Japan. Societ. Periodontol. 1991; 33 (4): 824–39. (in Japanese).
53 Imai H., Yanagihara K., Nobuto T., Ri S., Hiromi T., Yamaoka A. Morphological changes in the microvascular architecture of the vascular plexus of the periosteum following the free gingival autograft on denuded alveolar bone. J. Japan. Societ. Periodontol. 1994; 36 (3): 599–611.
54 Thoma D.S., Benić G.I., Zwahlen M., Hämmerle C.H., Jung R.E. A systematic review assessing soft tissue augmentation techniques. Clin. Oral Impl. Res. 2009; 20 (s4): 146–65.
55 Barbosa M.D., Gregh S.L.A., Passanezi E. Fibrin adhesive derived from snake venom in periodontal surgery. J. periodontol. 2007; 78 (10): 2026–31.
56 Barbosa F.I., Corrêa D.S., Zenóbio E.G., Costa F O., Shibli J.A. Dimensional changes between free gingival grafts fixed with ethyl cyanoacrylate and silk sutures. J. Int. Acad. Periodontol. 2009; 11 (2): 170–6.
57 Hassani A., Sadrimanesh R., Vahdati S.A., Sadr-eshkevari P. Free gingival graft immobilization: a pilot study on a newly designed stent. J. Oral Impl. 2010; 36 (2): 123–30.
58 Merli M. Implant therapy: the integrated treatment plan. Milan: Quintessenza edizioni; 2012; 1.